INTRODUÇÃOA exposição ao gás Amônia Anidra (AA) é potencialmente perigosa à vida, pois pode afetar gravemente o sistema respiratório (1).
Devido ao grande aumento do uso de AA líquida pressurizada utilizada na agricultura e na indústria, tem aumentado à exposição acidental e consequente inalação do gás (2).
As lesões causadas por queimaduras químicas são um desafio para os médicos, devido à baixa frequência de admissões hospitalares por esse tipo de acidente e, consequentemente, pouca experiência nessa área na unidade de queimados (3).
As lesões produzidas por produtos químicos cáusticos, ácidos e álcalis, mais comumente encontradas, são as causadas pelos ácidos, fluorídrico e fórmico, amônia anidra, cimento e fenol. Outros agentes químicos específicos que podem causar queimaduras são: fósforos, nitratos, hidrocarbonetos e piche (4).
A intoxicação por AA ocorre após exposição acidental durante a fabricação de fertilizantes, fibra têxtil, couro, plástico, pesticidas e explosivos. Acontece, também, durante as instalações de refrigeradores, onde é bastante usada (5).
Recentemente, tivemos a oportunidade de examinar três pessoas com disfonia por mais de 90 dias, após inalação de AA, causada por acidente de caminhão-tanque que capotou em uma estrada do litoral paulista, deixando vazar o gás no povoado ao longo da estrada.
Nesse vilarejo, 54 pessoas inalaram o gás e foram socorridas nos prontos-socorros e hospitais da redondeza.
O objetivo deste estudo é relatar três casos de sequelas laríngeas devido à inalação acidental de AA e realizar uma revisão da literatura.
RELATO DO CASOTrês pacientes foram por nós examinados, 90 dias após o acidente, pois ainda apresentavam disfonia, apesar do tratamento com antibióticos, corticosteroides, banho com muita água, lavagem intensa dos olhos e oxigenoterapia, instituído pelos médicos do hospital onde foram socorridos.
Caso 1 - ENS, 26 anos, sexo feminino, branca, do lar, apresentava exame otorrinolaringológico normal, com exceção das pregas vocais que, à videolaringoscopia, encontravam-se hiperemiadas, levemente edemaciadas e com leucoplasia em terço médio, bilateralmente (Figura 1). Foi medicada com corticosteroides e recomendada terapia fonoaudiológica.
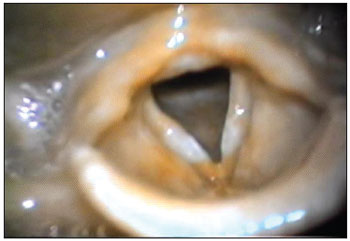
Figura 1. Laringite crônica. Videolaringoscopia mostrando hiperemia e edema das pregas vocais com leucoplasia, bilateralmente.
SRB, 40 anos, sexo feminino, branca, do lar, como não melhorou da dispneia com o tratamento instituído no hospital, foi necessária a realização de traqueostomia, permanecendo internada por 30 dias. A cânula traqueal foi retirada e o traqueostoma foi fechado após 60 dias, mas a disfonia persistiu. O exame otorrinolaringológico encontrava-se normal, com exceção das pregas vocais, que se apresentavam à videolaringoscopia, hiperemiadas e moderadamente edemaciadas, com presença de granuloma localizado no 1/3 posterior da prega vocal esquerda (Figura 2). Foi medicada com corticosteroides e aconselhada terapia fonoaudiológica.
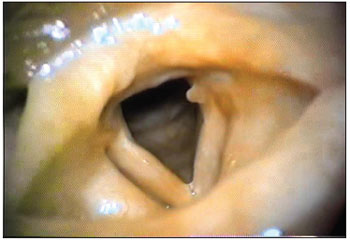
Figura 2. Laringite crônica com granuloma. Videolaringoscopia mostrando hiperemia, edema e granuloma em 1/3 posterior da prega vocal esquerda.
MCF, sexo masculino, 23 anos, branco, trabalhador rural, apresentava disfonia intensa e dispneia aos pequenos esforços. O exame otorrinolaringológico encontrava-se normal, com exceção das pregas vocais, que apresentavam à videolaringoscopia, hiperemia e sinéquia de todo 1/3 anterior e médio, com granulomas em comissura posterior, bilateralmente, levando a estenose de região glótica (Figura 3). Foi medicado com corticosteroides e, após 60 dias, os granulomas desapareceram permanecendo a estenose (Figura 4), sendo indicado tratamento cirúrgico e após, terapia fonoaudiológica.
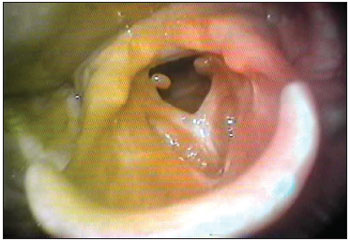
Figura 3. Sinéquia de pregas vocais com granulomas. Videolaringoscopia mostrando sinéquia das pregas vocais com granulomas cicatriciais.
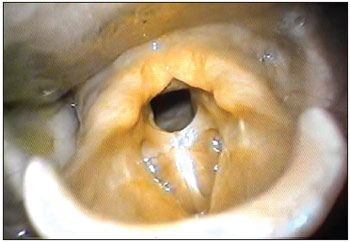
Figura 4. Estenose glótica. Videolaringoscopia mostrando a sinéquia das pregas vocais e consequente estenose glótica.
A amônia é conhecida desde a antiguidade. Plínio mencionou, em sua
Historie Naturalis, a existência de uma variedade de sal denominada
Hammoniacum. Em 1661, Robert Boyle escreveu na
Sceptical Chymis que o sal amoníaco é composto por ácido muriático e álcali volátil. Joseph Priestley, em 1774, foi quem pela primeira vez isolou a amônia gasosa, que chamou de ar alcalino (6).
O símbolo químico do álcali AA é NH3. Apresenta-se em temperatura ambiente como um gás incolor, com um odor fortemente pungente semelhante ao da urina ressecada. A água de amônia é uma solução de hidróxido de amônia a 10-30%. É um líquido incolor, com odor intenso, pungente e sufocante (7).
Por conter 82% de nitrogênio, a AA é considerada a maior fonte desse elemento. É um ótimo fertilizante e, portanto, muito usada na agricultura. É também usada na fabricação de fibras sintéticas, tais como o nylon e o rayon, bem como nas tinturas e limpezas de fibras naturais. A oxidação da amônia produz ácido nítrico, usado na produção de trinitrotolueno, nitroglicerina e outras substâncias. É também usada em refrigeração (9).
Apresenta riscos de incêndio e explosão, pois, como é um gás inflamável, forma misturas explosivas com o ar na faixa de 16-25% por volume de ar (10).
A AA irrita intensamente os olhos, nariz e vias respiratórias. Entre os efeitos tóxicos estão o lacrimejamento, as dificuldades respiratórias, dor no peito e edema pulmonar. Uma concentração de 10 ppm pode ser detectada pelo odor; a irritação de olhos e nariz é perceptível com cerca de 200 ppm. A exposição por poucos minutos a 3000 ppm pode ser intolerável, causando sangramento grave da pele, edema pulmonar e asfixia, levando à morte. É corrosivo para a pele porque reage com a umidade para formar hidróxido de amônio cáustico. Uma exposição prolongada pode causar destruição dos tecidos (10).
O contato com a pele determina queimadura grave, extremamente dolorosa. Há um edema inicial com formação de vesículas e, a seguir, ocorre necrose de liquefação, que vai se aprofundando progressivamente, cicatrizando por segunda intenção (7).
O contato com os olhos depende do tempo de exposição. Se rápida e pouco intensa, produz conjuntivite, lacrimejamento e fotofobia. Nos casos mais graves, ocorre dor intensa de conjuntiva, de pálpebras e ulceração de córneas (7).
O quadro clínico apresentado pelas pessoas que se intoxicaram depende do tipo de exposição. A ingestão de pH elevado, acima de 12, é grave e comumente associada à ulceração profunda das mucosas, principalmente do esôfago. Outros fatores influenciadores são: volume, concentração, viscosidade e molaridade. Os álcalis produzem necrose de liquefação, saponificando os lipídeos e solubilizando as proteínas, favorecendo o aprofundamento das lesões. Logo após a ingestão, aparece dor intensa, espasmo glótico, que por um lado impede a entrada de maior quantidade do gás e por outro pode determinar morte imediata por asfixia. Ocorre dor intensa, em queimação, referida na boca, garganta, região retroesternal e estômago. É comum a ocorrência de vômito, que pode ser em borra de café. Observa-se dificuldade de deglutição em todos os casos. A desidratação é intensa e de início rápido, com hipotensão arterial e choque, que pode evoluir para óbito. A lesão química apresenta característica de pseudomembrana de coloração cinza ou cinza-escura. Produtos sólidos determinam com mais frequência lesões na boca, faringe e região superior do esôfago. A ingestão de produtos líquidos, geralmente mais grave, pode produzir lesões esofágicas circulares, evoluindo sistematicamente para estenose cicatricial. Edema e inflamação da boca, língua, faringe e laringe diminuem o calibre das vias aéreas, facilitando o aparecimento de complicações pulmonares. Podem aparecer afonia, tosse, estridor, dispneia e cianose. Passada a fase inicial, o aparecimento de febre, dor retroesternal e abdominal é indicativo de possível perfuração esofágica com mediastinite. A perfuração do estômago, por outro lado, é rara. A estenose cicatricial de esôfago é a sequela mais comum (7).
Já a inalação produz intensa irritação respiratória, com tosse, dispneia e aumento de secreções brônquicas e, algum tempo depois, edema pulmonar, com piora da dispneia e aparecimento de cianose. Distúrbios respiratórios podem estar associados a outras manifestações sistêmicas, como cefaleia, tontura, fraqueza, hipotensão arterial e taquicardia. A exposição a grandes concentrações pode determinar morte imediata. Tosse, dispneia, estridor, cianose e reflexo vagal levando a espasmo glótico estão sempre presentes. A entrada do álcali na traqueia determina geralmente morte imediata por sufocação. Coma e convulsão são quase sempre manifestações terminais (7).
Sobonya (11) necropsiou uma pessoa e descreveu as alterações morfológicas e morfométricas pulmonares que levaram à morte, dois meses depois da exposição e inalação de AA. Os achados patológicos incluem bronquiectasias do lobo inferior, fibrose obliterante das vias aéreas inferiores e pneumonia terminal. A fibrose obliterante das vias aéreas inferiores é característica do estágio tardio da doença, levando a bronquiolite, provavelmente responsável pela doença pulmonar obstrutiva e pela sobrevida dos pacientes que inalaram AA.
Close et al (1) mencionaram que a exposição a AA pode resultar em danos substanciais ao sistema respiratório, olhos e pele. Fizeram um estudo retrospectivo e apresentaram as manifestações respiratórias agudas e crônicas em 12 pacientes expostos a AA como resultado de um mesmo acidente, e concluíram que: 1) A exposição à fumaça de AA, em alta concentração por curto período de tempo, afeta a pele, os olhos e as vias respiratórias superiores. Além disso, podem ocorrer sérias queimaduras na mucosa do nariz, da boca, da faringe, laringe e traqueia, e até obstrução respiratória alta. Recomenda-se a entubação precoce ou traqueostomia. Esses pacientes podem curar-se, porém com alguma sequela pulmonar. 2) Pacientes que inalaram AA em baixa concentração durante longo tempo não apresentaram obstrução aguda das vias aéreas superiores. O gás inalado se combina com a água de toda a superfície úmida da mucosa, resultando em extensa queimadura alcalina de toda árvore traqueobrônquica. No início, há poucos sinais e sintomas. Pode ocorrer queimadura de toda a mucosa pulmonar, resultando em pequena lesão pulmonar e edema. Como resultado, ocorre doença pulmonar crônica moderada a grave. 3) Pacientes expostos à inalação de moderada quantidade de AA, durante longo período de tempo podem apresentar poucos ou nenhum achado clínico ou laboratorial. Embora não esteja bem definido qual o melhor tratamento, seria, provavelmente, vantajoso incluir no tratamento, esteroides, antibióticos e ventilação mecânica.
No exame do tecido traqueobrônquico com microscopia eletrônica, constatou-se que, na morte aguda, ocorre denudação do epitélio traqueobrônquico, edema da lamina própria, sinais de edema alveolar, congestão e hemorragia (12).
Acompanhando-se por muitos anos um paciente que nunca fumou e foi vítima de exposição maciça ao gás AA, Leduc et al (5) verificaram que, na fase aguda, o paciente apresentou traqueobronquite grave e insuficiência respiratória causada por queimaduras graves na mucosa da árvore respiratória. Depois da fase aguda, o paciente ficou com obstrução respiratória significativa. Estudos do clearance mucociliar, tomografia computadorizada e broncografia, mostraram bronquiectasias moderadas. Concluíram que a exposição aguda a alta concentração de amônia poderia resultar em insuficiência respiratória aguda, levando também, com o passar do tempo, a alteração crônica da função respiratória.
A AA é uma combinação cáustica usada na indústria, e pode causar queimaduras graves, mesmo com breve contato. Assim como ocorre com outras queimaduras por álcalis, a lavagem precoce remove a amônia das áreas queimadas, sendo crucial para limitar o dano tecidual. Dois casos de exposição idêntica a vapores de AA foram estudados por Latenser et al (13), sendo que o primeiro foi lavado com água imediatamente após ocorrer à exposição, e o outro, só quando o paciente chegou ao hospital. O primeiro sofreu queimaduras menores e obteve alta médica após dois dias de hospitalização. O segundo sofreu queimaduras em 14% da superfície corporal e lesão inalatória significativa, sendo necessário entubação, ventilação mecânica e enxerto de pele, durante 13 dias de hospitalização. O tratamento precoce reduz significativamente a gravidade da queimadura.
Edlich et al (14) descrevem que fisiopatologicamente a maioria dos agentes químicos danificam a pele, mais por meio de uma reação química do que por uma ferida hipertérmica. Embora alguns agentes químicos produzam considerável calor como resultado de uma reação exotérmica quando entram em contato com a água, acabam produzindo trocas químicas diretamente sobre a pele, acarretando maiores danos. As trocas químicas dependem dos agentes, sejam eles ácidos ou alcalinos. A concentração do agente tóxico, bem como a duração do contato primário, determina o grau de destruição dos tecidos acometidos. Quando a pele é exposta à ação química da substancia cáustica, e sua cobertura de queratina é destruída e os tecidos da derme são expostos, ocorre ação necrótica contínua.
Os produtos químicos alcalinos dissolvem as proteínas e o colágeno, resultando em complexos alcalinos dessas moléculas. Ocorre também desidratação celular e saponificação dos tecidos gordurosos. Diferentemente das queimaduras ácidas, que são secas e com pouco edema, as alcalinas são marcadas por edema, grande umidade e perda de líquido. A neutralização da exposição ao alcaloide é realizada irrigando-se o local queimado com uma grande quantidade de água, para diluir todo o alcaloide presente na superfície da ferida, que ainda não produziu reação (14).
As queimaduras químicas continuam a destruir os tecidos até que o agente causador seja inativado ou removido. Quando se inicia a hidroterapia após o contato do produto químico com a pele, dentro de um minuto, a gravidade das lesões é menor do que quando se leva 3 minutos, por exemplo. O tratamento precoce normaliza o pH da pele. O tempo de contato do cáustico com os tecidos é determinante para a gravidade das lesões. A irrigação suave da pele, com grande volume de água e baixa pressão, por longo tempo, dilui o agente tóxico (14).
Após exposição a um alcaloide forte, a hidroterapia prolongada é especialmente importante para limitar a gravidade dos ferimentos. Em animais experimentais, o pH da pele quimicamente queimada não se aproxima da concentração normal, a menos que se mantenha mais de uma hora de irrigação contínua e, mesmo assim, apesar da hidroterapia, não retorna ao normal em menos de 12 horas (14).
Os vapores de amônia se dissolvem imediatamente na umidade da pele, dos olhos, da orofaringe, da laringe e dos pulmões, na forma de íons hidroxila, os quais causam queimaduras químicas, através de necrose de liquefação. A gravidade das lesões está diretamente relacionada com a concentração e duração da exposição à AA (14).
Macroscopicamente, constatou-se, em necropsia, que ocorre intensa congestão da superfície da mucosa da traqueia e brônquios. Todas as divisões pulmonares apresentavam bronquiectasias cilíndricas, afetando principalmente o lobo médio e os inferiores. Microscopicamente, a mucosa brônquica foi substituída por tecido de granulação, e grandes áreas foram destituídas de epitélio. Partes ulceradas e metaplasia escamosa estavam presentes nos subsegmentos brônquicos. A bronquiectasia estava associada à destruição das glândulas mucosas, da musculatura lisa, da cartilagem e da substituição por tecido fibroso vascular. Cada bronquíolo apresentava leve fibrose periadventícia ou aspecto de bronquiolite obliterante. Havia congestão, hemorragia e edema desigual do tecido alveolar (2).
A extensão das lesões respiratórias após inalação de AA depende da duração da exposição, da concentração do gás e da profundidade da inalação. Por ser altamente solúvel em água, a amônia é rapidamente absorvida pela membrana mucosa, reagindo com a água para formar hidróxido de amônia, que é altamente irritante e cáustico. São frequentes as queimaduras e descamações da camada epitelial da árvore brônquica (traqueobronquite). A absorção da amônia pelas vias aéreas superiores de certa forma protege os brônquios inferiores e os alvéolos da sua toxicidade (5).
Em pacientes que faleceram imediatamente após inalação de AA, observaram-se edema e hemorragia na laringe e nos pulmões. Em pacientes internados, observou-se que, dentro de poucos dias, sobrepôs-se infecção bacteriana. Os que sobrevivem às lesões agudas podem apresentar ou não evidências de doença pulmonar obstrutiva, como bronquiectasias e fibroses obliterantes das vias aéreas inferiores (11).
O tratamento inicial para quem inalou AA consiste em antibioticoterapia, broncodilatadores, corticosteroides e inalação de oxigênio (5). Nos casos mais graves, recomenda-se entubação nasal ou orotraqueal e, se necessário, traqueostomia. Após a entubação, as lesões das vias aéreas inferiores são controladas pela pressão expiratória final positiva (PEEP) (14).
Através da laringoscopia, observou-se que, após inalação de AA, pode-se encontrar desde eritema difuso e edema dos lábios, palato mole, parede posterior da faringe e epiglote, até queimaduras de primeiro, segundo e terceiro grau nas cavidades orofaríngeas, hipofaríngeas e laríngeas (1-9). Após 15 dias, pode-se observar, sobre a mucosa do palato mole, partes com fibrina e edema difuso com exsudato fibrinoso em toda a orofaringolaringe. Após 60 dias, observou-se melhora da disfonia, e a laringoscopia revelou leve edema de pregas vocais (1).
Algumas sequelas foram observadas, consistindo em danos aos sentidos (gustação, hipoalgesia, ou visão), disestesia grave, mudança na voz, perda de função pulmonar, anóxia cerebral e morte (3).
COMENTÁRIOS FINAISA inalação do gás AA resulta em um espasmo de glote que, por um lado, pode evitar que a fumaça atinja as vias aéreas inferiores, mas, por outro, mantém o gás em contato, por maior tempo, com a região glótica e supraglótica, podendo levar a uma queimadura mais profunda dessa região.
O próprio reflexo de defesa contribui para piorar o dano à laringe.
Apesar das queimaduras por álcalis resultarem em uma reação exotérmica quando entram em contato com a água, liberando calor, a irrigação prolongada neutraliza a toxicidade da AA, normalizando o pH da ferida. Quanto antes se iniciar o tratamento hidroterápico das áreas afetadas, a fim de se neutralizarem as queimaduras causadas pelo álcali, melhores serão os resultados do tratamento. Corticosteroides e antibioticoterapia também devem ser utilizados. Nos casos mais graves, é necessário entubação ou traqueostomia com ventilação mecânica.
Devido à dificuldade de se obter o tempo de exposição e consequentemente a quantidade de AA inalada e pela gravidade das sequelas apresentadas, é recomendada a realização de laringoscopias periódicas, durante, pelo menos, seis meses, para avaliação da laringe que pode mostrar desde laringites crônicas até a estenose glótica com insuficiência respiratória alta.
REFERÊNCIAS BIBLIOGRÁFICAS1. Close LG, Catlin FI, Cohn AM. Acute and chronic effects of ammonia burns of the respiratory tract. Arch Otolaryngol. 1980, 106:151-8.
2. Price SK, Hughes JE, Morrison SC, Potgieter PD. Fatal ammonia inhalation. A case report with autopsy findings. S Afr Med J. 1983, 64:952-5.
3. Wibbenmeyer LA, Morgan LJ, Robinson BK, Smith SK, Lewis RW, Kealey GP. Our chemical burn experience: Exposing the of anhydrous ammonia. J Burn Care Rehabil. 1999, 20:226-31.
4. Edlich RF, Farinholt HM, Winters KL, Britt LD, Long WB, Werner CL, Gubler KD. Modern concepts of treatment and prevencion of chemical injuries. J Long Term Eff Med Implants. 2005, 15:303-18.
5. Leduc D, Gris P, Lheureux P, Gevenois PA, De Vust P, Yernault JC. Acute and long term respiratory damage following inhalation of ammonia. Thorax. 1992, 47:755-7.
6. Felix EP, Cardoso AA. Amônia (NH3) Atmosférica: fontes, transformação, sorvedouros e métodos de análise. Química Nova. 2004, 27:123-30.
7. Schvartsman S. Cáusticos. Em: Schvartsman S, editor. Intoxicações agudas. 4ª. ed. São Paulo: Sarvier; 1979, pp. 179-83.
8. Hygienic Guide Series. Anhydrous ammonia NH3 (Revisão 1970). Am Ind Hyg Assoc J. 1971, 32:139-42.
9. Millea TP, Kucan JÔ, Smoot EC. Anhydrous ammonia injuries. J Burn Care Rehabil. 1989, 10:448-53.
10. Patnaik P: Gases comuns tóxicos e inflamáveis. Em: Patnaik P, editor. Guia Geral - Propriedades Nocivas das Substancias Químicas. Belo Horizonte: Ergo; 2002, vol. 1, pp. 399-40;
11. Sobonya R. Fatal anhydrous ammonia inhalation. Hum Pathol. 1977, 8:293-9.
12. Burns TR, Mace ML, Greenberg SD, Jachimczyk JA. Ultrastructure of acute ammonia toxicity in the human lung. Am J Forensic Med Pathol. 1985, 6:204-10.
13. Latenser BA, Lucktong TA. Anhydrous ammonia burns: case presentation and literature review. J Burn Care Rehabil. 2000, 21:40-2.
14. Edlich RF, Farinholt HM, Winters K L, Britt LD, Long WB, Werner CL, Gubler KD. Modern concepts of treatment and prevention of chemical injuries. J Long Term Eff Implants. 2005, 15:303-18.
1. Mestre em Medicina - Cirurgia de Cabeça e Pescoço - pelo HOSPHEL. Médico Chefe do Serviço de Otorrinolaringologia do Hospital da Sociedade Portuguesa de Beneficência de Santos.
2. Graduada em Fonoaudiologia pela Universidade Lusíada de Santos - UNILUS. Fonoaudióloga da Sociedade Portuguesa de Beneficência de Santos.
Instituição: Sociedade Portuguesa de Beneficência de Santos. Santos / SP - Brasil.
Endereço para correspondência:
Walter Paiva Cruz
Rua Olyntho Rodrigues Dantas 343 conj. 62 - Bairro: Encruzilhada
Santos / SP - Brasil - CEP: 11050-220
Artigo recebido em 04 de Maio de 2008.
Artigo aprovado em 09 de Fevereiro de 2009.